视频 | 上海科学家首次揭秘新生造血干细胞归巢全程

时讯
看看新闻Knews记者 朱厚真 刘宽漾
2018-11-20 17:58:56
为攻克“揭秘新生造血干细胞归巢全过程”这一世界造血干细胞研究领域的重大科学问题,潘巍峻研究员带领着平均年龄只有27.6岁的团队,历时6年,首次高清晰解析了体内造血干细胞归巢的完整动态过程,该研究成果于北京时间2018年11月20日凌晨在国际知名学术期刊Nature(《自然》)在线发表。

潘巍峻研究员及其核心研究团队 (后排从左向右为此项研究成果的共同第一作者李美、李丹彤、薛文志。)
造血干细胞是人体血液系统中的始祖细胞,它通过增殖分化产生红细胞、白细胞、血小板等人体内所有类型的血液细胞,从而维持生命的运转。造血干细胞在循环系统中游走寻找最适宜的组织或器官微环境的过程被称为归巢。只有寻找到自己的家,造血干细胞才能有效地发挥功能。
在学界,归巢这一概念早已被熟知,并在上世纪50年代被运用于骨髓移植治疗中。1990年,Edward Donnall Thomas因骨髓移植中的创造性贡献获得了诺贝尔奖。
“在理论极限上,一个造血干细胞就可以恢复人的整个造血系统,但在现实中一份脐带血往往不够一个成年人来完整治疗”,潘巍峻说。由于归巢现象发生在生物生命的整个过程中,时空跨度非常大,观察手段十分有限,人类一直无从得知归巢在生物体内究竟如何发生,归巢的微环境究竟是什么样的结构,这严重制约了临床造血干细胞移植等相关技术的发展。
为攻克这一科技难题,潘巍峻研究员带领其研究生团队历时6年,使用了斑马鱼进行活体成像,在国际上率先采用可变色荧光蛋白,建立了造血干细胞标记系统,在高分辨率共聚焦荧光显微镜下,建立了造血干细胞长时程活体观察追踪方案,从宏观到微观,生动地呈现了造血干细胞从诞生到归巢的全过程。
斑马鱼胚胎因为其造血干细胞诞生区域、造血组织等都和人体一致,且周身透明利于实现观测,被选作了模式生物。研究团队经过对大规模长时程斑马鱼活体成像的统计分析,发现了造血干细胞归巢的时空规律及“热点区域”,并结合精细成像和三维重构技术,首次揭示了体内造血干细胞归巢微环境的独特微血管结构。
斑马鱼和显微镜下的斑马鱼胚胎
在研究过程中,他们还意外地发现了一种全新的微环境细胞,并将其命名为“先导细胞”。这类细胞是一种之前未被定义过的巨噬细胞新亚型,存在于归巢“热点区域”附近,它们可以识别进入造血组织的造血干细胞并将其引入特定的血管结构中,从而实现造血干细胞的归巢。
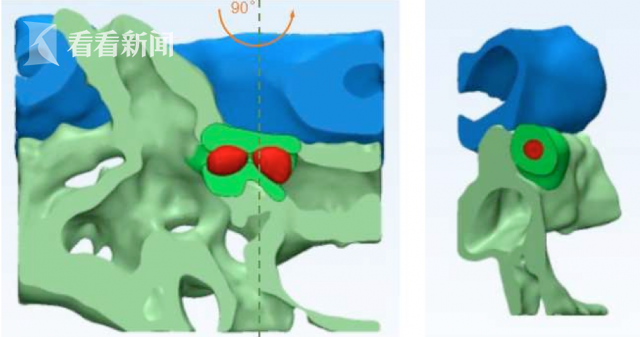
造血干细胞归巢停留“热点区域”的三维重构模型 (红色代表造血干细胞,蓝色代表动脉,绿色代表静脉。)
潘巍峻为这个“先导细胞”起的英文名字叫做usher cell:“先导细胞在巡逻,造血干细胞经过它的时候就会降速,如果没有这个先导细胞,造血干细胞是过家门而不入的,有了先导细胞,就可以在家门口迎候它,最后把它带进去。之后先导细胞又会离开,回到门口继续巡逻。”Usher这个单词在英文中意为招待员、剧院门口的引座员,用这个单词形容先导细胞,潘巍峻觉得再合适不过。
这一次基础研究的突破除了令学界振奋,也对临床的实践起到了促进作用。目前用于移植的造血干细胞的数量是非常有限的,造血干细胞的捐献,往往需要收集捐献者上亿的造血干细胞,但实际能够发挥作用的可能只有几百上千个。如果能让尽可能多的造血干细胞归巢,就能多一分成功的希望,使有限的造血干细胞可以救治更多人。因此,研究清楚归巢过程,找到其中关键的影响因素,就能提高治病的效率,给患者带来更多生的希望。
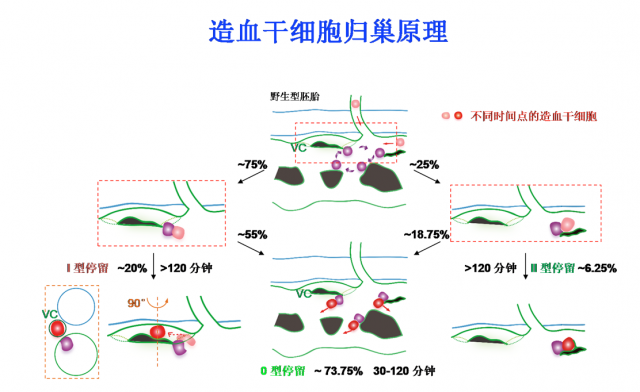
“先导细胞”引导造血干细胞进入血管微环境的原理图(紫色细胞为“先导细胞”,VC指示静脉微血管,绿色代表血管)
另外中科院分子细胞卓越创新中心/生物化学与细胞生物学研究所研究员景乃禾还指出,这项成果对于未来组织肿瘤远处转移的运用也会有非常大的前景。景乃禾说:“原发性癌如何转移到人体新的组织微环境,如何生根发芽,可能与造血干细胞的归巢现象有相似性。”
上述研究成果是在潘巍峻研究员带领李丹彤、薛文志和李美等研究生,与中国科学院生物化学与细胞生物学研究所李林、陈剑峰、周波研究员,中国科技大学姚雪彪教授,耶鲁大学医学院吴殿青教授等协同攻关下共同完成,并得到了西南大学罗凌飞教授和香港科技大学温子龙教授的帮助。
此项成果得到了中国科学院“细胞命运可塑性的分子基础与调控”战略先导计划和装备研制计划、科技部国家重点研发计划专项、国家自然科学基金面上项目、上海市科委基础重点项目等的支持。
(看看新闻Knews记者:朱厚真 刘宽漾 编辑:傅群)
版权声明:本文系看看新闻Knews独家稿件,未经授权,不得转载
暂无列表

全部评论