上海试点医疗器械注册人制度 上市时间大大缩短

时讯
看看新闻Knews记者 张英
2018-07-05 16:56:13
今天,医疗器械注册人制度改革又迈出了可喜的一步,试点范围从此前的浦东扩大至全市,全市的医疗器械注册申请人都可以实现注册和生产"解绑"。与百姓密切相关的医疗器械产品无需远渡重洋、也无需自主建厂,上市期提将大大提前,高端医疗器械本土化生产也将大大提速。
上午9点,捷普科技的生产线早已一片忙碌。这家全球第三大电子产品代工企业,正在为美敦力公司代工一款耳鼻喉科手术器械。以往,这些做好的产品必须拆成散件出口到新加坡,再重新组装,以进口方式销回国内。捷普科技(上海)有限公司总经理张岩向看看新闻Knews记者解释到:“国内制造在国内不能销售,因为我们不是品牌商,我们仅仅是生产企业,之前的政策需要医疗器械的注册和生产结合在一起,但我们没有这款产品的许可证。”
注册和生产"解绑"之后,这款产品无需远渡重洋,而是可以改为国内注册、直接上市,无论是时间成本还是物流成本都大大缩减。
产品持有人——美敦力大中华区高级质量控制经理仁民告诉看看新闻Knews记者:“这个产品进口注册 ,从申请到拿证差不多是一年时间。试点的国产注册,我们差不多用了一个月左右的时间,这个大大缩短了我们的注册流程,也使我们有条件尽快供应国内市场,上市时间有望大大提前。”
试点后,捷普陆续收到了国内外七八家研发机构抛来的橄榄枝,他们也正在扩充生产线,提高产能,促进高端医疗器械的本土化生产。
“我们因为订单的增加,今年在考虑把部分仓库挪到外面,这个部分就变成了生产线,所以你看到这边有分割墙,墙后面施工正在进行。”张岩告诉看看新闻Knews记者。
试点改革撬动了医疗器械行业的颠覆性变革,捷普、美敦力这些"吃螃蟹"的企业尝到了实实在在的"甜头"。然而因为试点区域只限于浦东,诸多有试点意向的企业只能通过在自贸区另设公司的方式参与试点,不少企业迫切希望试点范围扩大至全市。
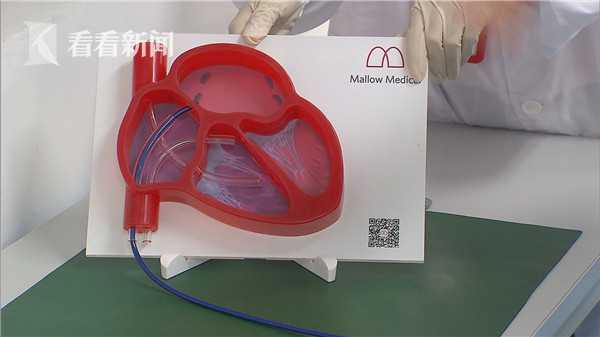
位于徐汇华泾镇的锦葵医疗就是其中之一,试点扩围后,他们的一款用于治疗儿童先天性心脏病缺损的植入装置,可以将需要独立注册的部件委托代工,企业则集中精力科技研发。
上海锦葵医疗器械有限公司总经理张瑾看看新闻Knews告诉记者:“我们将后端的推送装置委托给允许的制造基地来制造,这样我们更容易把精力集中起来,更好地为产品服务。”
试点扩围后,离病人最近的医院也在积极筹备,全市的医生、个人、机构都可以成为研发主体,不用再背负生产设备、人员、场地等资产运营压力,可将资源和精力更多投入到产品的研发创新上,有利于加快创新产品的推出和落地。
上海市糖尿病研究所所长贾伟平告诉看看新闻Knews记者:“我们六院有很多医生去想去这样做,把我们的创新能够转移给企业,企业通过转化再变成可以服务于病人身上用到的 新的技术、新的器械、新的手段,我觉得对于我们医疗行业是非常好的大好事。”

市食药监局表示,此前在浦东试点,已有三家企业的六个产品按照《试点方案》获准许可,57家企业有参与试点意向。试点扩围后,将进一步加大事中事后监管。
市食药监局医疗器械处处长林峰表示:“我们将把企业和产品列入重点监管计划,通过信息公示、质量保险 和跨区责任对接等措施,来加强对产品、企业的监管。”
目前,市食药监局正积极争取实现试点产品类别全覆盖。同时,期待将现有的医疗器械注册人制度在江浙沪三地适用,打破地域局限,适时推广到全国。
(看看新闻Knews记者:张英 实习编辑:杜丰洋)
版权声明:本文系看看新闻Knews独家稿件,未经授权,不得转载
暂无列表

全部评论